一場由長春長生引發的“疫苗事件”,在過去的一個多月,相關的調查、追責工作仍在繼續,但關于中國疫苗公共安全的追問仍遠未結束。
8月7日,國家衛生健康委員會、國家藥品監督管理局聯合印發《接種長春長生公司狂犬病疫苗續種補種方案》,為接種過長春長生狂犬病疫苗且尚未完成接種程序者,接種單位免費續種其他公司合格疫苗。
更早前的7月25日,長春長生公司董事長高某芳等16名涉嫌犯罪人員被公安機關刑事拘留,企業賬戶、個人賬戶被凍結,而包括江西在內的多個省份已暫停采購長春長生各類二類疫苗。
風起于青萍之末。雖然監管體系之嚴格堪稱世界級水平,但這次“疫苗事件”,反映出國產疫苗在生產、研發、質量控制、營銷模式及監管上存在的諸多問題,包括以低價中標導致的疫苗效價不可控。去病要去根,要重建公眾對中國本土疫苗信心,需要解決三個問題:
A.從立法層面建立疫苗風險管控制度。嚴格規范企業的“準入審核”,對疫苗從研發、臨床、上市到儲存、運輸、使用進行全程嚴格監管;出臺類似美國《國家兒童疫苗傷害法》(NCVIA),以此既保障了疫苗接種者的基本權益,又能保證疫苗供應商的積極性;
B.加大疫苗產業投入,鼓勵企業創新,保障正規企業合法權益。對貧困家庭的兒童接種二類疫苗提供援助,同時放開疫苗價格,以合適的利潤推動企業提升現有疫苗質量;
C.建立疫苗不良反應監控系統,以公開、透明數據應對公眾監督。建立類似美國CDC的疫苗不良反應監控系統,及時對公眾公開數據,破除信息的不對稱及接種者疑慮。
由于疫苗的特殊性,除了嚴格規范企業的“準入審核”,還應該加強疫苗監管部門及使用部門的協調,通過更詳細、更有效的法律以及嚴格落實監管體系,從研發、臨床、上市到儲存、運輸、使用進行更為科學、嚴格的監管,層層落實;另外匹配更嚴格懲罰措施,譬如造假上市公司退市制度。
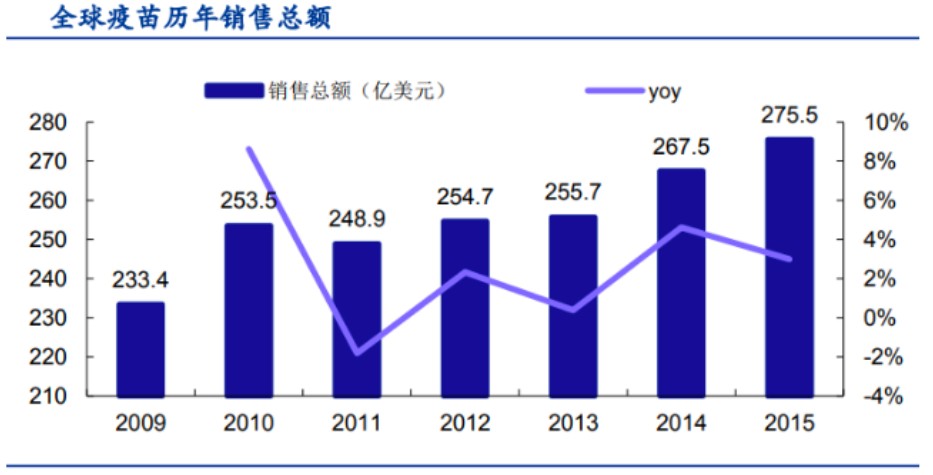
從全球競爭格局而言,2017年全球疫苗市場年銷售總額為277.82億美元,占全球藥品市場的3.4%,預計到2024年將達446億美元,復合增長率在7.1%。此中,“四大”疫苗巨頭(GSK、默沙東、輝瑞、賽諾菲)占據約85%的市場份額。
隨著整體接種意識的提升,預計中國等新興市場是全球疫苗市場的重要推動力量。故此,無論是從國家衛生安全角度考慮,抑或是立足于中國本土產業的發展,甚至是13.5億國人的疫苗接種廣泛性和安全性的出發,中國本土疫苗企業的質量等級、安全性級別、創新性均應再上層樓。
從企業來看,國內已誕生智飛生物、華蘭生物、沃森生物、康希諾生物等知名疫苗企業,且這些企業尚無一例發生產品召回事件。但要重獲國人信心,并能在國際化進程中與四大國際巨頭爭有一席之地,仍然任重道遠。
疫苗事件為什么發生在百白破?
百白破疫苗主要由白喉疫苗、破傷風疫苗和百日咳疫苗組成。
根據媒體報道,此次被爆出的百白破疫苗事件,實際上是去年年底的問題,具體包括兩個生產企業,即長春長生和武漢生物。國家藥監局公告顯示,百白破疫苗的主要問題,檢驗時發現“效價測定”項不符合規定,其主因是百日咳成分上。
目前國內僅有三家生產百白破疫苗,分別是:長春長生、武漢生物、沃森生物。除了前兩個公司成為此次疫苗事件主角外,沃森生物亦于2017年首次生產過百白破,但其中送檢的有一批次即不合格,主要也是百日咳效價問題。
在上海市疾病預防控制中心免疫規劃科主管醫師陶黎納看來,中國當前僅有的三家百白破疫苗生產企業,全都遭遇百日咳不合格。說明我國在百日咳的質量標準和檢定標準上遇到技術障礙,并非企業故意為之。
簡單來說,國產百白破疫苗(包括國產四聯疫苗)里的百日咳處于“混沌”狀態,使得疫苗有效成分種類和含量不確定,質量差異比較大,“廠家自檢合格,國家抽檢不合格,也是可以預期的”。
作為對比,國外百白破疫苗里百日咳成分組成很明確,一般至少包含2個成分(巴斯德的五聯疫苗,含類毒素和絲狀血凝素各25ug),也有包含3組分的(GSK的四聯疫苗,含類毒素、絲狀血凝素和粘附素)。
故此,解決這一問題的方法,是學習國外百白破疫苗的方法,將百日咳組分抗原、精準定量,如此可以做到效價可控。
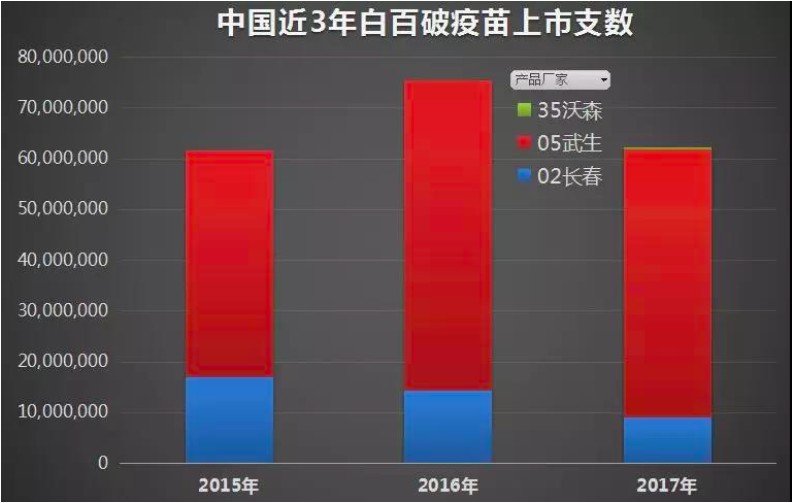
但為什么長春長生、武漢生物、沃森生物沒有學習國外企業如此做呢?答案是成本。
當前我國白百破疫苗每劑采購價才3.4元,白破疫苗才1.1元。作為對比,史克公司的英芬立適在美國疾控中心的疫苗采購清單上,價格是18.2美元,折合人民幣124元。兩者價格差異之大,高下立判。
中美疫苗價格差異可達數十倍,造成這樣的差異,主要是因為價低中標機制。為了在各省疫苗招標中中標,本土企業往往以更低的價格參標,后期企業更容易選擇造假以降低成本,一旦爆出丑聞,會嚴重影響公眾對本土疫苗的信心和接受程度。此次的長春長生便是前鑒。
值得欣慰的是,目前國內企業正在做類似歐美這樣的嘗試,譬如康希諾。智通財經APP翻看康希諾招股書看到,該公司百白破(嬰幼兒、加強針和成人)均是組分技術,正是直接解決國內百白破這一癥結的最佳方案。
從企業來看,目前我國取用一類疫苗由政府采購,免費向公民提供;二類疫苗由公民自費購買接種,常見的有:十三價肺炎結合疫苗、口服輪狀病毒疫苗、甲肝疫苗、HIB疫苗、流感疫苗、狂犬病疫苗等。
在未來,考慮到疫苗公共安全的覆蓋面,可以對貧困家庭的兒童接種二類疫苗提供援助,降低由于經濟原因而放棄疫苗接種的情形。此外,適當放開疫苗價格,減輕廠家成本壓力,使廠商有動力投入資金研究開發新疫苗,改進工藝,提升現有疫苗質量。
需要對國內的疫苗安全失去信心嗎?
如果從“疫苗事件”中摘離而出,做一個理性的思考,對于“是否對國內疫苗安全失去信心”這一問題,答案是否定的。
實際上,中國擁有比肩世界先進水平的疫苗監督體系,對進口疫苗的審批則更是把關嚴密。根據《藥品注冊管理辦法》,進口疫苗被批準國內上市之前,必須開展臨床試驗,除了臨床試驗外,還要經過1至5年不等的評審時間,才能頒發《進口藥品注冊證》。以宮頸癌疫苗為例,2006年在美國上市,此后迅速在全球100多個國家和地區(包括港澳臺)被批準使用,然而內地卻拖了整整十年,才同意讓宮頸癌疫苗入華。
這導致不少民眾對疫苗監管頗有微詞。但智通財經APP認為,疫苗事關13億國人健康,政府對進口疫苗的謹慎是可以理解的,且國內疫苗生產企業產能已可滿足國內基本需求。目前,內地已對甲類和乙類傳染性疾病中的大多數有了比較穩定的控制,對丙類傳染性疾病的控制能力還很低,應當在保持安全性的前提下,增加短缺品種的進口,讓民眾享受到生命安全服務。
數據同時會說話。
A.合格率達到世界級水平。國家藥監局的監測數據顯示,2008年以來,國家藥品抽檢計劃共抽檢疫苗產品944批次,合格率99.6%,合格比率與年提升。以近40年的發展——改革開放才是中國疫苗產業現代化的起點,即保障了13億國民的健康,中國本土疫苗企業的功勞不可抹殺;
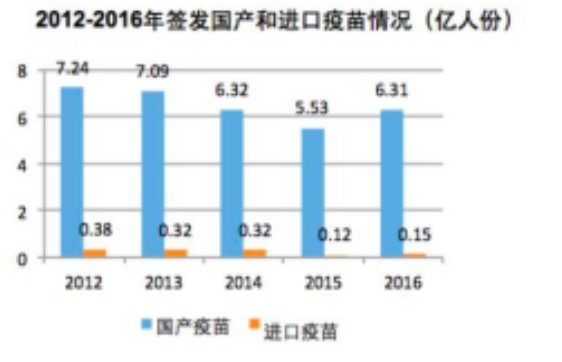
B.大幅降低國民多種疾病的發病率和死亡率。中國已經是世界第一的疫苗生產大國和使用大國,每年批簽發疫苗5-10億人份,其中國產疫苗占據絕大部分份額,占95%以上,進口疫苗僅占5%以下。在這發展和替代過程中,有效預防多種疾病的發病與流行。有例為證,從1978—2014年:全國麻疹、百日咳、白喉、脊髓灰質炎、結核、破傷風等6種疾病的發病率和死亡率降幅達99%以上;
C.世界級的疫苗監管體系。中國逐步構建起日益嚴格的疫苗安全標準和生產監管體系,并且于2011年、2014年兩次通過世界衛生組織(WHO)的疫苗國家監管體系評估。已有國產疫苗通過WHO產品預認證,聯合國兒童基金會、全球疫苗免疫聯盟陸續采購這些疫苗用于其他國家的疾病預防控制。
目前的問題在于,我國疫苗行業起步較晚,目前整體尚處于早期發展階段,渠道營銷、追逐利潤仍是行業發展的本質,銷售費用高企、商業賄賂事件頻發,尊重生命、重視質量的行業氛圍有待提高,良性的行業生態尚未有效建立。
與此同時,與歐美日等發達國家相比,國產疫苗在品種、質量、監管上均存在差距。如美國的疫苗監管在全世界是最系統和最嚴格的。美國1990年成立“疫苗不良反應報告系統”,包括疫苗生產廠商、醫務人員、受種人等均可提交信息;美國還設立“國家疫苗傷害賠償項目”,完善疫苗異常反應事件的后續賠償。在醫療事故方面,美國還建立國家無過錯賠償制度。
在這方面,中國可以向美國學習,《國家兒童疫苗傷害法》和國家疫苗傷害賠償項目,從疫苗價格中征收一部分金額,用于支付疫苗接種者的不良反應,將極大地減少疫苗接種者的后顧之憂,使他們更加樂于接受疫苗。
據智通財經APP了解,國內已有部分疫苗生產廠家針對自己生產的疫苗為接種者免費購買保險,或由部分地區政府購買保險,但這仍只是個案,未來仍需擴展到全部企業。這也是重建公眾信心的制度和物質保障。
錨定國產疫苗的發展方向:從渠道營銷導向轉向技術創新導向
疫苗誕生于十八世紀末,作為醫學史上最偉大的發明之一,問世不久就成為了讓人類免受很多疾病侵擾的希望和曙光。
嚴格的標準與要求,使之有著比一般原研藥更高的技術壁壘、成本投入和研發周期——平均在十年以上,但其也是一個國家醫療健康水平的體現和創新之所在。
我國有45家疫苗生產企業,可生產63種疫苗,預防34種傳染病,是世界上為數不多的能夠依靠自身能力解決全部計劃免疫疫苗的國家之一。從2005年到2015年的十年間,我國疫苗產業市場規模從65億元增至245億元,年均復合增長率達14%。
但也存在多問題,譬如具有大品種研發能力的企業少,半數以上企業僅擁有單種產品;疫苗產業現狀是生產導向型,加以銷售催化——國內一類苗和傳統二類苗品種市場已經基本飽和,供應充足甚至過剩,競爭激烈,發展空間主要依靠政策和結構變動。
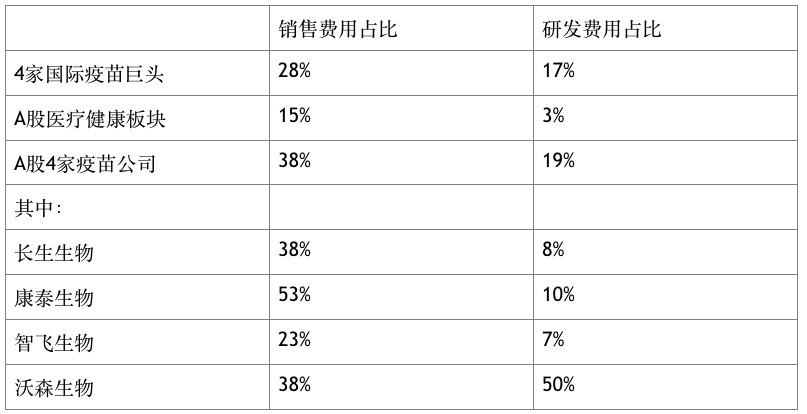
從科研投入來看,其與國際巨頭亦存在巨大差距。以A股為例,目前上市有4家以疫苗為主業的企業。Wind數據顯示,2017年4家疫苗公司總銷售費用達18億元,占營業收入38%;4家國際疫苗巨頭(輝瑞、默沙東、賽諾菲、GSK)總銷售費用占比28%。反觀研發費用,A股醫療保健板塊總研發費用319億元,占總營業收入的2.8%;4家疫苗公司除沃森生物外,研發費用占比均未超過10%;4家國際疫苗巨頭總研發費用占比17%。
這導致的后果是,疫苗面臨的主要問題是:重磅品種發展滯后:一些國際疫苗市場的重要品種在我國仍未上市或比例嚴重偏低(如HPV疫苗,13價肺炎球菌多糖結合疫苗、輪狀病毒疫苗、四價流腦結合疫苗、四價流感疫苗等)。此外,多聯疫苗水平低,數量少。多聯疫苗是未來的發展趨勢,不僅節省疫苗接種的人工和成本,減少就診時間和注射次數,降低嬰幼兒接種痛苦,簡化接種程序,具有重要意義。
值得關注的是,隨著全球民眾健康意識的整體提升,全球疫苗市場的需求仍將保持較高增速。據EvaluatePharma估測,2020年全球疫苗市場年銷售總額將達到347億美元。此一數據,較之2017年增長約25%。
高速成長的市場和全球的需求必將呼喚創新型企業的出現。
從國內來看,目前創新型企業已開始初露鋒芒,如國產疫苗創新范例的EV71(腸道病毒71型)病毒疫苗,中國昆明所、北京科興和中生集團等研發的產品已于2015-2016年先后上市,進度全球領先;康希諾的重組埃博拉病毒疫苗已通過CFDA的新藥注冊申請,該藥品較之國外研發的必須在-60度超低溫儲存的埃博拉病毒試驗疫苗具備更優良的穩定性,在非洲等高溫地區運輸、使用時,對歐美同行有很大的領先優勢。更多的疫苗企業創新仍在路上,或已經進入應用階段。如華蘭生物的成人型疫苗有望2018年第四季度上市,這也是我國首個上市的四價流感疫苗,也是目前唯一一個;沃森生物正在全力推進13價肺炎結合疫苗申報生產和上市工作,同時進一步加快二價HPV疫苗的產業化進度。
資本市場與企業研發的結合成了新近的亮點,華蘭生物、沃森生物、智飛生物等企業已先后IPO成功。新近的7月16日,康希諾生物亦正式向港交所遞交了上市申請文件,此舉也意味著該公司有望坐穩港股“疫苗第一股”。
據康希諾上市申請文件披露,這家位于天津的疫苗企業是由多名跨國制藥公司高管回國創立的,公司主要研發生產全球創新、國內首創和國內最佳的三個疫苗類別,目前公司正在12個疾病領域研發15種疫苗。成立以來,備受資本市場關注,其股東包括禮來亞洲基金、啟明創投、國投創新及達晨創投等多家國內外知名投資機構。在此前發布的《中國硬獨角獸TOP100》中,康希諾名列榜單之列。希望這家與眾不同的疫苗企業能夠為中國疫苗產業帶來新氣象。
90列25中國是全球最大的疫苗生產國,全球沒有那么大的產能給中國供應合格疫苗。在長春長生造假事件之后,中國疫苗的監管只會更加嚴格,在此事件推動下,國內疫苗企業的質量管理和產品創新只會加速。
從長期來看,疫苗行業的持續增長遵循醫藥發展的必然規律——技術能力決定企業價值。從發展趨勢來看,新型疫苗(結合疫苗、多聯多價疫苗、特種疾病疫苗)已成為公認的主流,需要企業具備針對性的疫苗分離、純化,甚至部分特定結構的培養生產、糖基化等高難度制備技術,這是傳統疫苗企業不具備的技術能力,需要企業加大研發投入,引入生物工程領域的高級人才團隊。
在國內疫苗品種同質化嚴重的環境下,具備新型疫苗開發能力的企業將具備持續成長的動能,而這也是助推著中國整體疫苗行業的集體變革——從渠道銷售導向型向技術創新導向型的轉變,這也是行業未來國際化的機會,華為當年也是這樣做的。(虎臣)

